El inhibidor de la quinasa Janus upadacitinib es un tratamiento potencial para la artritis psoriásica. No está clara la eficacia y seguridad de upadacitinib en comparación con adalimumab, un inhibidor del factor de necrosis tumoral α, en pacientes que tienen una respuesta inadecuada a los fármacos antirreumáticos modificadores de la enfermedad no biológicos.
Métodos
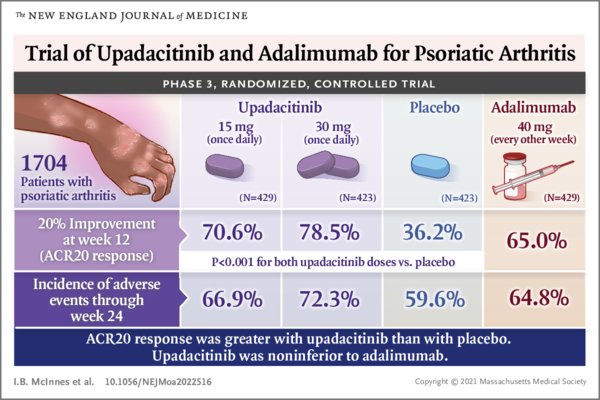
En un ensayo de fase 3 de 24 semanas, asignamos pacientes al azar en una proporción de 1: 1: 1: 1 para recibir upadacitinib oral en una dosis de 15 mg o 30 mg una vez al día, placebo o adalimumab subcutáneo (40 mg cada dos semana). El criterio de valoración principal fue una respuesta del American College of Rheumatology 20 (ACR20) (disminución ≥20% en el número de articulaciones sensibles e hinchadas y mejoría ≥20% en al menos tres de los otros cinco dominios) en la semana 12 con upadacitinib en comparación con placebo. Los puntos finales secundarios incluyeron comparaciones de upadacitinib con adalimumab.
Resultados
Un total de 1704 pacientes recibieron un fármaco activo o placebo. El porcentaje de pacientes que tuvieron una respuesta ACR20 en la semana 12 fue del 70,6% con upadacitinib de 15 mg, del 78,5% con upadacitinib de 30 mg, del 36,2% con placebo (P <0,001 para ambas dosis de upadacitinib frente a placebo) y del 65,0% con adalimumab.La diferencia entre los grupos para upadacitinib de 15 mg en comparación con adalimumab fue de 5,6 puntos porcentuales (intervalo de confianza [IC] del 95%, −0,6 a 11,8) y para upadacitinib de 30 mg en comparación con adalimumab fue de 13,5 puntos porcentuales (IC del 95%, 7.5 a 19.4). Ambas dosis de upadacitinib no fueron inferiores a adalimumab para la respuesta ACR20 en la semana 12; la dosis de 30 mg, pero no la de 15 mg, fue superior a la de adalimumab. La incidencia de eventos adversos hasta la semana 24 fue del 66,9% con upadacitinib de 15 mg, del 72,3% con upadacitinib de 30 mg, del 59,6% con placebo y del 64,8% con adalimumab. Hubo infecciones graves en el 1,2%, 2,6%, 0,9% y 0,7% de los pacientes, respectivamente. Se produjeron trastornos hepáticos en el 9,1% de los pacientes del grupo de upadacitinib de 15 mg y en el 12,3% de los del grupo de upadacitinib de 30 mg.pero se produjeron aumentos de grado 3 en los niveles de aminotransferasas en el 2% de los pacientes o menos en todos los grupos.
Conclusiones
El porcentaje de pacientes con artritis psoriásica que tuvieron una respuesta ACR20 en la semana 12 fue significativamente mayor con upadacitinib de 15 mg o 30 mg que con placebo. La dosis de 30 mg, pero no la de 15 mg, fue superior a la de adalimumab. Los eventos adversos fueron más frecuentes con upadacitinib que con placebo.
The NEW ENGLAND JOURNAL of MEDICINE -1 de Abril 2021-
